La forma della Terra
26 Novembre 2020La tettonica delle placche
29 Dicembre 2020I silicati sono i minerali più abbondanti nel nostro pianeta dato che costituiscono circa il 75% dei minerali presenti sulla crosta terrestre.
In questo post vediamo come i silicati sono strutturati e come vengono classificati.
La struttura dei silicati
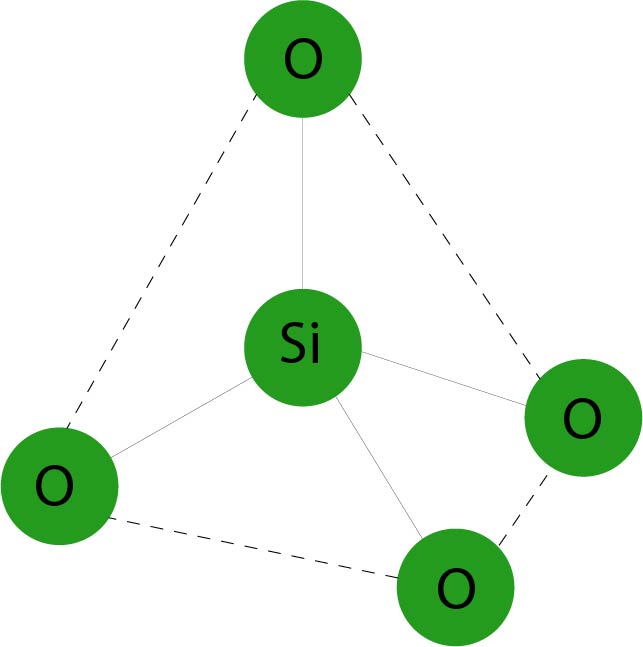
Il mattoncino fondamentale del reticolo cristallino dei silicati è lo ione silicato (SiO44- ) . Questo ione ha una forma tetraedrica, con al centro lo ione Si4+ e ai vertici quattro ioni O2-.
Questo tetraedro però non è elettricamente stabile: infatti la combinazione di quattro ioni ossigeno ( ognuno con due cariche elettriche negative) con uno ione silicio ( che ha quattro cariche elettriche positive) lo lascia con quattro cariche negative in più.
Per stabilizzarsi il tetraedro si deve legare con ioni positivi o deve mettere in comune i propri atomi d’ossigeno con altri tetraedri vicini.
I silicati vengono classificati in funzione della disposizione dei tetraedri. In particolare si tiene conto del numero di tetraedri legati tra loro e della loro disposizione spaziale.
Silicati con tetraedri isolati: i nesosilicati
Nei nesosilicati nessun atomo di ossigeno fa da ponte tra tetraedri adiacenti.Tutte le cariche negative in eccesso nei tetraedri vengono occupate con ioni metallici positivi ( i più comuni sono ferro e magnesio).
I nesosilicati hanno un colore scuro e densità alta.
Data l’elevata densità si trovano maggiormente nel mantello che nella crosta terrestre. Dato che i tetraedri sono isolati, i nesosilicati hanno una struttura uniforme in tutte le direzione perciò sono minerali molto compatti. Per questa caratteristica, molti nesosilicati sono apprezzati come gemme.
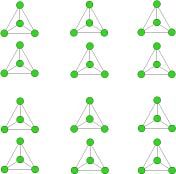
Nesosilicati importanti sono l’olivina, i granati e gli zirconi.
Silicati con tetraedri a coppia: i sorosilicati
Sono silicati nei quali i tetraedri formano delle coppie con un vertice condiviso. L’epidoto è tra i sorosilicati più importanti.
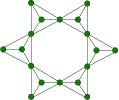
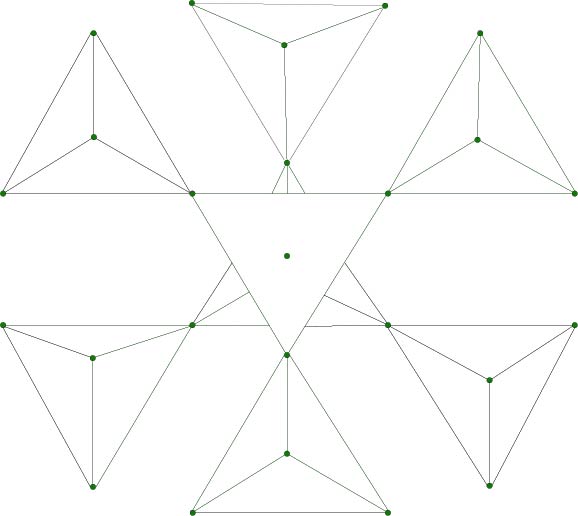
Silicati con tetraedri ad anello: i ciclosilicati
Silicati ad anelli di tetraedri. Tre o più tetraedri formano una struttura ad anello grazie al fatto che ciascun tetraedro condivide due vertici. Il berillo e la tormalina sono ciclosilicati.
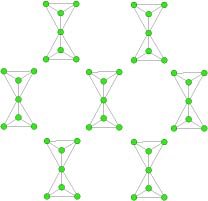
Tetraedri a catena: gli inosilicati
Gli inosilicati sono dei silicati a catene di tetraedri. Possono essere a catena singola e a catena doppia.
Silicati a catena singola
I pirosseni sono inosilicati a catene singole, nei quali ciascun tetraedro condivide due atomi di ossigeno con due tetraedri adiacenti. Nella catena si hanno legami molto forti. Un esempio di silicato ad anello singolo è l’augite, appartenente alla famiglia dei pirosseni.
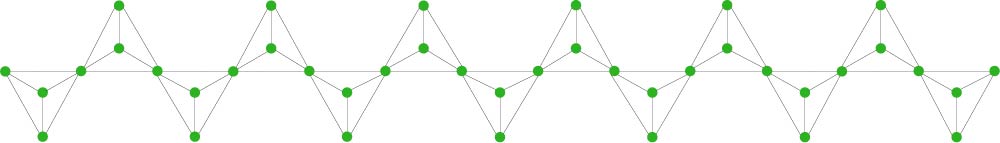
Silicati a catena doppia
In questi inosilicati i tetraedri condividono alternativamente due atomi e tre atomi di ossigeno con i tetraedri adiacenti. La doppia catena è data da una lunga sequenza di anelli esagonali che condividono due lati con gli anelli adiacenti.
I legami fra le doppie catene sono deboli quindi questi minerali sono facilmente sfaldabili. L’inosilicato a doppia catena più rappresentativo è l’orneblenda.
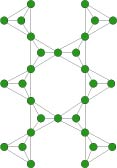
Tetraedri a foglio: i fillosilicati
Nei fillosilicati ogni tetraedro condivide tre atomi di ossigeno con tre tetraedri adiacenti e hanno una struttura “a pastasfoglia”: i tetraedri sono disposti in piani paralleli.
La struttura del minerale è bilanciata elettricamente da ioni positivi posti fra i piani di tetraedri tendoli uniti con legami deboli. Perciò molti fillosilicati tendono a sfaldarsi in sottili lamine.
Le miche sono un gruppo importante di fillosilicati.
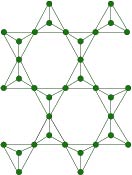
Silicati con tetraedri 3d: i tectosilicati
I tectosilicati hanno una struttura cristallina tridimensionale dove ogni atomo di ossigeno fa da ponte tra due tetraedri. La struttura cristallina dei tectosilicati è perciò omogenea. Tectosilicati sono il quarzo e i feldspati.
Se vuoi consultare minerali in maniera interattiva ti consiglio Mindat. Ogni minerale ha una pagina molto approfondita con foto, caratteristiche cristallografiche e molto altro!
Approfondimenti
Per approfondire l’argomento trattato in questo post ti consiglio i seguenti testi:
Hai trovato utile questo articolo? Fammi sapere cosa ne pensi nei commenti e condividilo nei social!



